1) Généralités
Déf 2 : la maladie d’Alzheimer une maladie neurodégénérative responsable de trouble neurocognitif (TNC) majeur
Physiopathologie 1A : la cause de la maladie d’Alzheimer n’est pas identifiée mais une partie de la cascade biologique menant à la mort des neurones est connue.
Epidémiologie
– La plus fréquente des démences (80% en Europe 1B), en particulier chez le sujet âgé
– Prévalence (en augmentation régulière) : 1 millions de patients en France, 2-4 % après 65 ans et 15 % après 80 ans 1A, prédominance féminine 1B
2) Diagnostic 2
| Clinique | Paraclinique |
|---|---|
| TNC majeur | IRM cérébrale systématique |
A ) Clinique
-
Anamnèse
Terrain
– Sujet âgé (75-85 ans ++)
– Notion d’antécédents familiaux
Facteurs de risque
– Facteurs non modifiables : âge, genre (sexe féminin ++), allèle ε4 de l’apolipoprotéine E homozygote (dans les rares formes monogéniques de transmission auto. dominante, <1% des patients) 1A, autres gènes de susceptibilité (gènes des préséniline 1 et 2, de l’APP) 1B
– Facteurs modifiables : HTA, diabète, obésité, athérosclérose, hypercholestérolémie déclarés entre 45-55 ans, traumatismes crâniens 1B
Facteurs protecteurs
– Niveau d’éducation élevé
– Alimentation de type méditerranéen
– Pratique régulière d’une activité physique ou des activités sociales
Signe fonctionnel : Rupture avec le fonctionnement et le comportement antérieurs du patient (témoignages de personnes fiables et ressentis du patient)
-
Examen physique 1A
Phase pré-démentielle (prodromale) : l’autonomie est préservée. Troubles de la consolidation en mémoire épisodique (atteinte des régions temporales internes)
– Plainte mnésique ++ : oubli à mesure, parfois nié (rapporté par l’entourage)
– Epreuve des 5 mots : les rappels ne sont pas aidés par les indices de catégorie
– Evaluation neuropsychologique de la mémoire : tests plus complets (« rappel libre / rappel indicé à 16 items ») montrant un effondrement des capacités à rappeler les informations, avec des intrusions (ajouts de mots qui n’étaient pas dans la liste)
Phase démentielle : L’autonomie est significativement altérée. Aux troubles de la mémoire s’ajoute :
– Atteinte ± sévère des fonctions instrumentales avec un syndrome aphaso-apraxo-agnosique
– Atteinte des fonctions exécutives (extension des aires corticales associatives)
Phase démentielle avancée (démence sévère). La perte d’autonomie est totale, souvent à ce stade, le patient est institutionnalisé. Les troubles touchent l’ensemble des fonctions cognitives, jusqu’à la non-reconnaissance des proches. Il peut exister des troubles du comportement (agitation et apathie, déambulation) et d’autres signes neurologiques :
– Epilepsie, myoclonies
– Troubles de la marche et de la posture avec chutes
– Syndromes pyramidal et extra-pyramidal
– Hallucinations
– Troubles du sommeil et de l’appétit
– Troubles du contrôle des sphincters
Remarques : les tests de repérage des TNC (exemple : MMSE) ne sont pas suffisants pour poser le diagnostic et en déterminer l’origine
B ) Paraclinique
Le diagnostic de certitude repose sur la neuropathologie (post mortem) 1A
IRM cérébrale
– Systématique
– Retrouve une atrophie des hippocampes
Imagerie métabolique 1A
– Scintigraphie de perfusion : montre une hypoperfusion des régions corticales associatives et temporales internes
– TEP : montre un hypométabolisme des mêmes régions
Biomarqueurs (ponction lombaire) 1A : le profil typique montre
– Une baisse massive d’Aβ42
– Une augmentation de TAU 0 et TAU-p
– Si le profil n’est pas typique, des rapports entre les différents marqueurs sont utilisés avec des normes spécifiques.
– Une PL strictement normale élimine le diagnostic.
C ) Diagnostic différentiel 1A
Causes de syndrome démentiel curable (cause organique) :
– métabolique : hypothyroïdie, la carence en B12 et folates,
– infectieux : syphilis, VIH
– méningiome frontal
– hydrocéphalie à pression normale
– hématome sous-dural chronique
– démence vasculaire
– encéphalopathie subaigüe : Creutzfeld-Jacob, encéphalite auto-immune…
IRM cérébrale
Bilan biologique plasmatique
– Bilan minimum : NFS-plaquettes, VS, ionogramme avec calcémie, TSHus, glycémie à jeûn
– ± dosage B9-B12, sérologique syphilitique et VIH (selon le contexte)
Autres causes démentielles
– Dégénerescence lombaire fronto-temporale : troubles comportementaux +++
– Maladie à corps de Lewy diffus : syndrome parkinsonien et hallucination +++
Syndrome confusionnel (la confusion n’élimine pas la démence, mais doit la faire rechercher à distance)
Troubles de la mémoire « pseudo-amnésiques » (retrouvée dans des situations fonctionnelles telles que dépression, troubles du sommeil, anxiété, prise excessive de psychotropes) : Altération de la qualité de l’enregistrement et du rappel en mémoire mais pas de la consolidation. Dans l’épreuve des 5 mots, les rappels sont aidés par les indices de catégories.
Dépression 2
D) Synthèse (Dg pos.)
Le diagnostic de maladie d’Alzheimer repose sur des arguments positifs et négatifs !
| Arguments positifs |
Arguments négatifs |
|---|---|
| Clinique : profil des troubles cognitifs IRM : atrophie hippocampique Imagerie métabolique : hypométabolisme et/ou hypoperfusion des cortex associatifs Détection des biomarqueurs (PL) : profil intrathécal des protéines TAU, TAU phosphorylée et Aβ42 |
Biologie plasmatique (démences secondaires…) Imagerie : pas d’autres lésions |
=> L’association clinique (pos.) + IRM (pos. et neg.) + bilan biologique plasmatique (neg.) est indispensable et suffit dans l’immense majorité des cas à porter un diagnostic de haute probabilité. La PL et la scintigraphie sont réservées aux formes de diagnostic difficile.
=> Cette association est intégrée et décrite en termes de maladie d’Alzheimer incertaine / possible / probable / certaine par les critères du NINCDS-ADRDA. Les critères diagnostiques du DSM-4 sont plus généraux (diagnostic de démence) 1B, 4
3) Evolution 1A
L’histoire naturelle est classiquement comme suit :
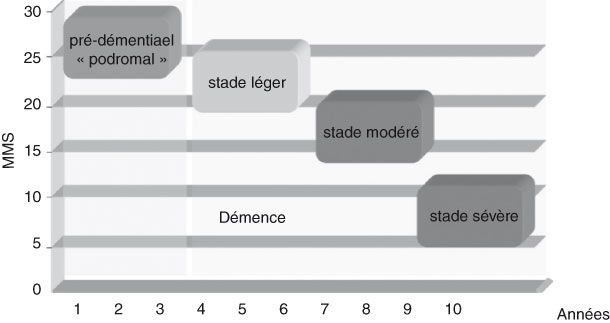
Le stade de démence sévère survient en moyenne 7-8 ans après la détection des premiers symptômes de la maladie. Le décès survient par une complication générale (surinfection bronchique, suite d’une chute avec alitement prolongé).
4) PEC 2
A ) Bilan initial 1A
Recherche de comorbidités : albuminémie et fonction rénale
Bilan de sévérité : La démence peut-être évaluée par le MMS (Mini Mental Status). On distingue 4 stades de sévérité des TNC majeurs : formes légère (MMSE > 20), modérée (MMSE : 16-20), modérément sévère (MMSE : 10-15) et sévère (MMSE : 3-10)
Bilan pré-thérapeutique en cas d’utilisation d’anticholinestérasiques : ECG
B ) Traitement 2
-
Mesures générales
Annonce du diagnostic au cours d’une consultation mémoire
Elaboration du plan de soins et d’aide 0
– Mise en place de l’ALD 15
– Prise en charge des comorbidités et des facteurs de risque
– Surveillance nutritionnelle
– Orientation vers les services sociaux (mise en place des aides et des financements)
– Information sur les associations de malades et de familles de malades et les structures de répit
Mesures hygiéno-diététiques 1A
– Activités physiques quotidiennes
– Sorties quotidiennes
– Eviter le retrait social et l’absence de stimulation physique et cognitive
-
Traitement médicamenteux
Traitement spécifique : Quatre médicaments disposent de l’AMM pour le traitement symptomatique. Cependant, ils ne sont plus recommandés ni remboursés !
– Formes légères (MMSE > 20), modérées (MMSE : 16-20) ou modérément sévères (MMSE : 10-15) : rivastigmine, donépézil, galantamine (inhibiteurs de la cholinestérase)
– Formes modérés à sévères (MMSE : 3-10) : mémantine (antiglutamate)
Note :
– La prescription est obligatoirement initiée par un neurologue, un psychiatre ou un gériatre.
– Selon Prescrire, l’ensemble de ces médicaments sont à écarter des soins (effet indésirable > effet thérapeutique) 5
Psychotropes 1A (à utiliser avec grande prudence ++++) : Ils peuvent être prescrits pour limiter les troubles du comportement. Dans les troubles majeurs du comportement résistant à toute autre approche, on peut utiliser des neuroleptiques, au risque d’une grabatisation très rapide (préférer des neuroleptiques « atypiques » à la plus faible dose possible).
Remarque : Limiter ou arrêter les médicaments aggravant potentiellement les troubles cognitifs (psychotropes, en particulier anticholinergiques)
-
PEC globale
| TNC léger | TNC majeur stade léger |
TNC majeur stade modéré |
TNC majeur stade modérément sévère |
TNC majeur stade sévère |
|
| Repères cliniques et score MMSE© à titre indicatif |
Oublis, anxiété, affects dépressifs, autonomie |
Trouble cognitif, perte d’autonomie limitée aux activités complexes et une anxiété majorée
MMSE© = 21-25 |
Perte d’autonomie touchant les activités complexes et élémentaires
MMSE© = 16-20 |
Début de la dépendance et début des troubles du comportement
MMSE© = 10- 15 |
Dépendance majeure et troubles du comportement
MMSE© = 3-10 |
| Stratégie médicale |
Maintenir un niveau d’autonomie et de bien-être |
Cf. stade léger | Maintenir un niveau d’autonomie et de bien- être, une activité motrice et sensorielle |
Éviter le repli psychique et sensoriel Prise en charge de la grande dépendance |
|
| Objectifs thérapeutiques patient |
Thérapie cognitive basée sur la pleine conscience, relaxation
Activité physique |
Stimuler…
Programmes de Maintenir ses Traiter la souffrance |
Stimuler…, Rassurer, orienter et aider sans assistance Prendre en charge la souffrance psychique
Prévenir la perte |
Stimuler… Rassurer, orienter assister, et ritualiser Traiter la souffrance psychique
Prendre en charge la |
Stimulation adaptée : basale, sensorielle Éviter les surstimulations
Prendre en charge la |
| Objectifs thérapeutiques aidant |
Explication des changements
Adhésion au |
Former et soutenir l’aidant
Prévenir et traiter la Prévenir le risque Inciter |
Cf. stade léger | Cf. stade léger
Accompagner |
Cf. stade léger |
| Environnement | Organiser la vie quotidienne
Aide à domicile Mesures de protection |
Cf. stade léger | Réfléchir aux limites du maintien à domicile, à l’indication d’entrée en institution ou à une présence majorée des soignants à domicile, jusqu’à 24h/24h |
Environnement adapté et sécurisé
Supervision et soutien |
|
| Démarche et techniques de soins / (où ?) |
Information sur les risques à venir
Déstigmatisation Ateliers cognitifs Soutien |
Formation des aidants non professionnels
Prise en charge de la Éducation Éducation |
Formation des aidants non professionnels
Prise en charge de Éducation Supervision et |
Cf. Stade modéré | Techniques comportementales adaptées aux problèmes rencontrés
Supervision et soutien (SSIAD EHPAD, etc.) |
| Ressources et compétences/ (qui ?) Information auprès des CLIC/MAIA/PTA |
Aidants : Proches Aidants : Café des aidants, groupe de parole, plateforme de répit
Patients : Assistant de vie sociale pour les programmes de stimulation personnalisés, spécialiste d’activité physique adaptée, kinésithérapeute, aide-soignante, aide médico-psychologique, assistant de soins en gérontologie, équipe ESA, infirmier(-ère), aide médicopsychologique. A et P : ergothérapeute, orthophoniste, psychologue, psychomotricien, kinésithérapeutes, équipe ESA ou des MDPH pour les sujets jeunes, accueil de jour, spécialistes des TNC, gériatres, équipes mobiles, UCC, UHR, PASA, cadre de santé, médecin coordonnateur, équipe de soins des EHPAD. |
||||
C) Suivi 2
Suivi partagé au moins annuel entre le spécialiste et le généraliste
| items | souligner le positif | alerte, risque et piste d’action |
| Médicaments | Pas d’erreur, pas d’oubli par le patient/ entourage (médicaments, posologie) : le patient et l’entourage maîtrisent seuls ou avec une aide extérieure le traitement médicamenteux.
L’entourage est formé aux risques liés |
Erreur, oubli, événement indésirable grave
Réviser l’ordonnance, former l’aidant et Reprendre l’information sur les médicaments à |
| Comorbidités | Maladies chroniques stables avec suivi médical organisé. Le diagnostic de TNC est partagé avec les spécialistes qui prennent en charge le patient. | Contact avec les spécialistes dans le respect du secret professionnel pour s’accorder sur les priorités médicales, objectifs thérapeutiques et les médicaments indispensables |
| Activité physique (périmètre de marche, qualité de l’équilibre et de la marche, nutrition, iatrogénie, facteurs de risque cardiovasculaire) |
Elle est régulière, adaptée. Il n’y a pas de troubles de la marche ou de l’équilibre ou de chutes. Le médecin encourage cette activité. | Chutes ou diminution de l’activité physique : rechercher les causes possibles avec l’entourage et les intervenants au domicile.
Prévention active des chutes. Contacter le kinésithérapeute ou les spécialistes du handicap et de la chute. |
| Autonomie fonctionnelle et vie sociale | Interventions de réhabilitation adaptées aux choix et préférences du patient. Elles sont suivies et bien acceptées par le patient et l’entourage. Elles sont perçues comme utiles par ces derniers. |
Si diminution de l’autonomie fonctionnelle ou de la vie sociale : un point est nécessaire avec les intervenants au domicile, les spécialistes de la réhabilitation (ergothérapeute ou équipe ESA), la psychologue, l’orthophoniste, ou les spécialistes du handicap… |
| Qualité de vie, du sommeil , de l’appétit, de la relation avec l’aidant |
Hygiène et conditions de vie sont adaptées, ainsi que le logement. L’entourage est formé, empathique, maîtrisant les techniques de communication et d’apaisement. |
Quelques signes d’alerte : distorsion entre le vécu de l’aidant et le vécu de l’aidé ; perte de poids (dénutrition) ; changement d’attitude, troubles émotionnels majorés ; etc. |
| Étape psychique de l’aidant et de l’aidé | Absence de trouble psychique chez l’aidant et le patient ou de troubles comportementaux chez le patient. | Proposer un suivi psychologique pour l’aidant, pour le patient, évaluer la relation aidant/aidé comme cause possible des troubles psycho-comportementaux |
| Hospitalisation programmée | L’équipe hospitalière est informée ; la prise en charge est adaptée pour réduire le risque de syndrome confusionnel et de perte d’autonomie. La sortie est préparée et l’aidant accompagné. |
Il existe un risque de syndrome confusionnel et de dépendance au cours d’un séjour hospitalier (dépendance iatrogène). Anticiper la sortie et ne pas trop solliciter l’aidant. |
| Passage aux urgences ou hospitalisation non programmée |
Prendre les mesures pour réduire le risque de dépendance iatrogène et préparer la sortie d’hospitalisation.
Favoriser l’admission directe dans un |
Revoir causes et circonstances de l’hospitalisation. Adapter, le cas échéant, la surveillance et les soins à domicile. |





4 réponses à “Maladie d’Alzheimer”
Ah, du nouveau : les médicaments sont déremboursés (contre l’avis de sociétés savantes cependant)
Quel est l‘intérêt de la VS, la calcémie et la glycémie dans le bilan bio „indispensable“ ?!?!
Le traitement dépend du MMSE (mini mental State examination de Folstein)
D’après HAS :
• au stade léger (MMSE > 20) : un inhibiteur de la cholinestérase ;
• au stade modéré (10 < MMSE < 20) : un inhibiteur de la cholinestérase ou un antiglutamate ;
• au stade sévère (MMSE < 10) : un antiglutamate.
➪ Modalités de titration : les traitements sont institués à la dose minimale et la posologie est éventuellement augmentée progressivement jusqu’à la dose maximale préconisée et tolérée.
➪ Revoir le patient à 1 mois pour une évaluation de la tolérance et un ajustement de la posologie soit par le médecin primoprescripteur, soit par le médecin généraliste traitant ou un autre spécialiste qui assure le suivi du patient
(a savoir que seul 33% des patients diagnostiqués Alzheimer bénéficient d'un traitement)
(source pour les infos : HAS)
Il s’agit ici de la reco HAS 2011, qui ne semble plus être à jour ! Les médicaments ne sont plus vraiment indiqués, et ne sont d’ailleurs plus remboursés !