1) Généralités 2
Déf : les arthrites juvéniles idiopathiques (AJI) constituent un ensemble de cinq entités que sont : la forme systémique d’AJI, les AJI oligo- ou polyarticulaires, les polyarthrites rhumatoïdes juvéniles, les spondylarthropathies, et les AJI non classables (Pediatric Rheumatology European Society : PReS)
Epidémiologie
– Prévalence en Europe et en Amérique du Nord : 16-150/100000
– Nombres d’enfants âgés < 16 ans atteints d’AJI ≅ 4000 patients (donné française)
Classification
– Selon la classification de l’International League of Association for Rheumatology (ILAR) : ordre décroissant de fréquence
. Forme systémique d’AJI (FS-AJI) dite maladie de Stil
. Forme oligoarticulaire
. Forme polyarticulaire sans facteur rhumatoïde dite séronégative
. AJI associée aux enthésopathies
. AJI associée au psoriasis
. AJI polyarticulaire avec FR (polyarthrite rhumatoïde juvénile)
. les arthrites inclassables
– Selon la Pediatric Rheumatology European Society (PReS)
. AJI oligo ou polyarticulaire avec anticorps antinucléaires débutant avant 6 ans
. polyarthrites rhumatoïdes juvéniles
. spondylarthropathies
. AJI non classables
Facteurs étiologiques
Les facteurs étiologiques sont multiples et le mécanisme est complexe
– Environnementales
– Immunologiques
– Génétiques
. génotype HLA B-27 (AJI associée aux enthésites)
. mutation du gène LACC1 avec deux phénotypes prédominants (AJI systémique ou AJI polyarticulaire avec ac antinucléaires négatifs)
– Autres facteurs
2) Diagnostic 2
| Clinique | Paraclinique |
|---|---|
| douleurs articulaires d’horaire inflammatoire mono, oligo- ou polyarthrites |
– |
A ) Clinique
-
Forme systémique d’AJI (FS-AJI)
Terrain : âge = 1-5 ans (rare avant 1 an et à l’adolescence)
Critères diagnostics (ILAR, 2001)
– Fièvre quotidienne pendant > 15 jours avec caractère typique de la courbe (température prise et notée toutes les 4 heures) : 1-2 pics ≥ 39°C quotidiennes avec retour rapide à une température normale ou basse (typiquement < 37°C) entre les pics.
– Une ou plusieurs arthrites (peut apparaître après plusieurs mois ou années) ± arthralgies/myalgies
– Au moins un des éléments ci dessous
. éruption cutanée : macules transitoires survenant lors des pics fébriles (typiques, très évocatrices du diagnostic si associées à une ou des arthrites). Rare présence d’un dermographisme ou d’un aspect urticarien
. hépatomégalie, splénomégalie, et/ou adénomégalies
. sérite (péricardite, épanchement pleural, épanchement péritonéal)
– Evolution des symptômes sur ≥ 6 semaines
Formes atypiques
– Courbe thermique non typique, absence d’arthrite pendant plusieurs mois ou années
– Absence d’éruption maculeuse typique
– Eruption urticarienne
Note : en absence d’arthrite documentée, le diagnostic sera considéré comme probable
-
Formes polyarticulaires sans facteur rhumatoïde
Terrain
– âge variable
– femme +++
Signes cliniques
– Polyarthrites se manifestant par atteinte de ≥ 5 articulations dès les 6 premiers mois d’évolution
– Forme classique
. atteinte articulaire symétrique et à prédominance distale
. fièvre absente ou modérée ++
– Forme atypique
. début insidieuse de l’atteinte articulaire (épaississement synovial important)
. formes avec peu ou pas de synovite clinique (raideur d’installation progressive)
. association fréquente à une uvéite antérieure chronique, insidieuse, à « œil blanc »
-
Formes oligo-articulaires
Terrain
– Formes à début précoce +++
. 90% chez une fille de < 3 ans
. association à une uvéite +++
– Formes à début tardif
. grands enfants +++ (garçons surtout)
Signes cliniques
– Atteinte de 4 articulations au maximum au cours des 6 premiers mois d’évolution
– Au delà de 6 mois : oligoarthrite persistante ou étendue
– Atteinte articulaire souvent symétrique (membres inférieurs ++)
– Fièvre absente ou modérée et transitoire
-
AJI aux enthésites
Terrain
– âge de début : après 6 ans +++ (10 ans en moyenne)
– sexe masculin +++
Signes cliniques
– Atteinte articulaire typiquement limitée à 4 articulations (membres inférieurs +++)
. le plus souvent asymétrique
. les articulations sont gonflées ± douloureuses et limitées
– Atteinte du squelette axial (douleur du rachis dorsal ou lombaire, des articulations sacro-iliaques) rare au début
– Douleurs d’enthésites (au niveau des zones d’insertion des tendons) présentes dans 1/3 des cas au début
. au niveau du pied : insertion de l’aponévrose plantaire et du tendon d’Achille
. au niveau du genou : insertion du tendon rotulien sur la tubérosité tibiale antérieure
– Uvéite douloureuse à l’œil rouge (en début ou en cours d’évolution)
B ) Paraclinique
Aucun examen paraclinique n’est nécessaire pour poser le diagnostic positif.
C ) Diagnostic différentiel
-
FS-AJI
Devant les formes incomplètes ou atypiques
– infection bactérienne, virale ou parasitaire (leishmaniose viscérale +++)
– arthrite réactionnelle
– affection maligne
. leucémie aiguë
. lymphome
. neuroblastome
. etc.
– Maladie systémique
. maladie de Kawasaki dans une forme incomplète (surtout avant l’âge de 2 ans)
. maladies inflammatoires chroniques de l’intestin (MICI) : maladie de Crohn +++
. ± lupus systémique (surtout chez une fille âgée de plus de 8 ans)
. hépatite auto-immune
. maladie de Castleman
– Syndrome auto-inflammatoire d’origine génétique
. syndrome TRAPS (TNF Receptor associated periodic syndrom)
. fièvre méditerranéenne familiale (présentation atypique, myosite fébrile et prolongée)
. déficit partiel en mévalonate kinase ou syndrome avec hyper IgD
. syndrome de Muckle-Wells
. syndrome CINCA (syndrome chronique inflammatoire neurologique cutané et articulaire)
. granulomatoses systémiques
. mutations de NLRC4
– Syndrome d’activation macrophagique (SAM) non lié à une FS-AJI notamment déficits immunitaires héréditaires (lymphohistiocytoses familiales notamment chez le très jeune enfant)
– Allergie médicamenteuse de type DRESS (Drug Rash with Eosinophilia and Systemic Symptoms)
Devant une fièvre prolongée
– infection
– maladie systémique
– néoplasie
Devant une fièvre récurrente : syndrome auto-inflammatoire
-
Formes polyarticulaires sans facteur rhumatoïde
– Manifestations articulaires en rapport avec un agent infectieux
. rhumatisme articulaire aigu
. arthrites post-streptococciques
. borréliose de Lyme
. Rickettsioses
. Brucellose
. Salmonellose
. Maladie des griffes du chat
. infections virales
– MICI
– Sarcoïdose
– Maladie auto-immune
. lupus systémique
. connectivite mixte (syndrome de Sharp)
. poly- ou dermatomyosite
. sclérodermie
. syndrome de Sjögren
– Vascularite (PAN, maladie de Wegener)
– Affection maligne (leucémie aiguë, lymphome)
-
Formes oligoarticulaires
En cas d’atteinte ≥ 2 articulations : idem que la forme précédente
En cas d’atteinte mono-articulaire
– Infection bactérienne +++ (si atteinte récente)
– Traumatisme
– Malformation synoviale
– Dystrophie synoviale
– Angiome synovial
– Tumeur synoviale
– Ostéochondrome
– Epanchement hémorragique secondaire à un trouble de l’hémostase
-
AJI associée aux enthésites
– Manifestations articulaires d’origine infectieuse (plus que fréquente chez les enfants jeunes et ayant une atteinte mono-articulaire)
– Manifestation articulaire « post-infectieuse » type arthrite de Lyme
– Arthrites réactionnelles post infectieuse Streptocoque, Yersinia, Salmonella, Shigella
– Maladies systémiques auto-immunes
– Artérite de Takayasu (devant une forme associée à un syndrome inflammatoire persistant)
– Affection maligne (devant un tableau très algique et une AEG)
3) Evolution 2
FS-AJI
La maladie peut se révéler par ses complications
– Complications rénales : amylose rénale (devenue exceptionnelle), glomérulonéphrites (rares)
– Complications cardiovasculaires : péricardite, myocardite, hypertension artérielle, hypertension artérielle pulmonaire, Insuffisance cardiaque secondaire à une myocardite (rare)
– Syndrome d’activation macrophagique (SAM) = première cause de mortalité aiguë au cours de FS-AJI dans l’enfance
– Retard de croissance
– Ostéoporose
– Infections
Formes polyarticulaires sans facteurs rhumatoïdes
– Survenue d’une uvéite torpide ⇒ cécité définitive en absence de dépistage précoce et traitement approprié
– Facteurs de mauvais pronostic
. atteinte symétrique et distale
. syndrome inflammatoire biologique
. anomalies structurales préexistantes
AJI associée aux enthésites : Uvéites bruyantes
4) PEC 2
A ) Bilan initial
| Bilan |
| FS-AJI Clinique – Antécédents familiaux de fièvre récurrente, de maladie auto-immune – Notion de griffure par un chat, d’indigestion de lait de chèvre (recherche de brucellose) – Notion de voyage à l’étranger et/ou en zone d’endémie (paludisme, leishmaniose, typhoïde, Lyme, etc.) – Notion de d’AEG, de douleurs osseuses, de douleurs ostéoarticulaires nocturnes, de sueurs, d’infléchissement de la croissance staturo-pondérale – Notion d’atteinte digestive, neurologique, cutanée (en dehors de l’éruption maculeuse évocatrice de FS-AJI), musculaire ou de tout autre organe. – Examen clinique complet avec étude de la courbe de croissance staturo-pondérale (attention particulière aux muqueuses : bouche, anus) Biologie – Hémogramme avec étude du frottis sanguin – VS, CRP – ASAT, ALAT, Gamma GT – LDH (évoquer une pathologie maligne si élévation franche) Note : une élévation modérée peut être observée au cours d’une authentique FS-AJI – Fibrinogène – Ionogramme sanguin, créatininémie, protidémie, électrophorèse des protéines plasmatiques – Ferritinémie dont l’élévation très marquée doit faire suspecter un SAM – Hémocultures – BU (dépistage protéinurie, hématurie) – Selon le contexte : sérologies (EBV, CMV, Griffe du chat, …) Imagerie – Radiographie du thorax – Echographie abdomino-pelvienne (syndrome tumoral ± épaississement des parois digestives) – Echographie cardiaque |
| Formes polyarticulaires sans facteur rhumatoïde Clinique – Interrogatoire . antécédents familiaux . séjour en zone d’endémie d’un agent infectieux . symptômes associés – Analyse de la courbe de croissance staturo-pondérale – Examen clinique complet : recherche soigneuse de signes extra-articulaire notamment cutanée (psoriasis, érythème noueux) – Examen ophtalmique Biologie – Hémogramme, VS, CRP, ANA, Créatininémie, transaminases, BU – Recherche de facteurs rhumatoïdes (FR) et Ac antipeptides citrullinés (ACPA) après l’âge de 6 ans (éliminer une PR en cas de symptomatologie clinique évocatrice) Imagerie – Rx des articulations atteintes – Rx systématique des mains et des poignets et des pieds : pour les formes avec facteurs de mauvais pc – Echographie en mode B et doppler des articulations le plus fréquent touchées (pognet, MCP, Coude, Genou, Cheville) Notes – Rx non indiquées en cas d’accessibilité à l’IRM, à la TDM et au Cone Bean CT devant une atteinte des articulations temporo-mandibulaires – Rx non indiquées en cas d’accessibilité à l’IRM (sauf Rx de profil) devant une atteinte rachidienne cervicale |
| Forme oligo-articulaire (Clinique et Biologie idem que forme polyarticulaire) En cas de monoarthrite récente + fièvre – VS, CRP, NFS – Ponction articulaire à visée bactériologique – Hémoculture – Prélèvement de toute porte d’entrée infectieuse éventuelle En cas de monoarthrite persistante – IRM avec injection de gadolinium – Arthroscopie avec biopsie synoviale Note : devant toute épanchement interarticulaire chez le jeune garçon, faire une étude du TCA (hémophilie) |
| Forme associée aux enthésites Clinique – Interrogatoire . antécédents familiaux (spondylarthrites, uvéite, maladie inflammatoire digestive) . ancienneté des symptômes et horaire de la douleur – Examen clinique complet . signes articulaires . signes cutanés éventuels . signes digestifs . évaluation de la courbe de croissance staturo-pondérale afin de ne pas méconnaitre une MICI Biologie – Hémogramme, VS, CRP – Recherche de l’Ag HLA B27 (ne peut infirmer ou affirmer le diagnostic) – Anticorps anti-nucléaire (selon le cas) |
B ) Traitement
-
FS-AJI
Objectifs
– Mise en rémission la plus rapide possible (< 1 semaine) des manifestations systémiques (fièvre, asthénie, anémie) ; mise en rémission de l’atteinte articulaire
– Dépistage et traitement des complications de la maladie
– Adaptation du traitement en fonction de l’évolution
– Prévention des effets secondaires des traitements
– Assurer la bonne qualité de vie et le bon développement psychosocial de l’enfant
Traitement médicamenteux
En 1ère intention : AINS (en absence de contre-indication et de critères de gravité)
– AINS utilisés
. Indométacine : 2 – 3 mg/kg/jour en 2-3 prises per os . Dose maximale : 150 mg/jour (Hors AMM avant 15 ans)
. Naproxène : 20 – 30 mg/kg/jour en 2 prises. Dose maximale : 2 400 mg/jour (Hors AMM pour les doses préconisées)
. Ibuprofène : 30-40 mg/kg/jour en 3-4 prises. Dose maximale : 2 400 mg/jour (Hors AMM pour les doses préconisées)
. Diclofénac : 3 mg/kg/jour en 2 prises ( dose maximale : 150 mg/jour)
– Effets indésirables cliniques et biologiques
. Toxicité digestive : douleurs abdominales, anorexie, diarrhée, saignement occulte
. Céphalées, changement de comportement, troubles cognitifs nécessitant un changement d’AINS ou une réduction de la dose
. Éruption cutanée pseudo-porphyrique (naproxène) nécessitant l’arrêt du traitement
. Toxicité hépatique (élévation des transaminases) nécessitant la réduction de la dose ou l’arrêt temporaire du traitement (si transaminases > 2 fois la limite normale supérieure)
. Toxicité rénale (IR réversibles, nécrose tubulaire aiguë, néphrite interstitielle, dysfonctionnement tubaire) nécessitant arrêt du traitement
. Toxicité hématologique (rarement agranulocytose, leucopénie, aplasie médullaire, thrombocytopénie)
. Survenue d’un syndrome d’activation macrophagique nécessitant une prise en charge en urgence.
– En cas de rémission sous traitement pendant 1-3 mois
. les AINS sont diminués progressivement en quelques mois en fonction de l’évolution clinique jusqu’à un arrêt éventuel
En cas d’échec ou d’intolérance des AINS sans complication vitale
En 1ère intention : corticothérapie générale
– Eviter une exposition prolongée à des doses élevées (amorcer si possible une décroissance vers le 15è jour en visant une dose < 0,3 mg/kg/jour à 3 mois ou 10 mg/jour pour le grand enfant)
Note : une biothérapie anti-IL1 peut être discutée avant une corticothérapie générale (hors AMM) après avis d’expert
– Antagoniste du récepteur IL1, Anakinra : 2 mg/kg/jour (max 100 mg). Pour un poids < 20 kg, discuter des doses plus fortes (3-5 mg/kg/jour sans dépasser 100 mg/jour)
En seconde intention
– En absence d’une réponse clinique après 1-2 semaines de corticothérapie (ou cortico-dépendance en cours de décroissance ou effet secondaire majeur)
. biothérapie anti-IL1 ou anti-IL6
Note : ne pas freiner la décroissance de la corticothérapie générale, ni prendre la décision hâtive d’introduire un traitement de fond sur des paramètres uniquement biologiques.
– En cas d’intolérance chez un ayant initié un traitement anti-IL1 avant corticothérapie ou en absence de réponse clinique après optimisation des doses)
. discuter une corticothérapie générale seule ou en association : après quelques jours sur les signes systémiques (fièvre, rash, sérite) ou quelques semaines sur l’atteinte articulaire
En troisième intention
– En cas d’échec d’une corticothérapie générale et d’une première biothérapie
. discuter un changement de biothérapie au sein d’une même classe thérapeutique ou en changeant de classe.
– En cas de formes réfractaires aux traitements précédents avec signes systémiques persistants
. méthotrexate ± biothérapie partiellement efficace sur atteinte articulaire. Méthotrexate 1 fois/semaine : 10-15 mg/m2 (sans dépasser 25 mg/semaine). AMM per os le matin à jeun ou SC
. Anti-TNF α et abatacept (formes d’évolution polyarticulaire et peu inflammatoires)
. Thalidomide (tératogène et neurotoxique ++, réaliser une EMG avec mesure des vitesses de conduction nerveuse tous les 6 mois et arrêt du traitement cas d’anomalie)
. Immunosuppresseurs (ciclosporine)
. Autogreffe voire allogreffe de cellules souches hématopoïétiques (se discute très exceptionnellement)
Note : durée du traitement
– En cas de maladie inactive prolongée (plusieurs mois) et déjà sevrés de corticothérapie
. discuter une décroissance thérapeutique avec un espacement ou une diminution de dose des traitement en cours
. ± arrêt sous surveillance attentive du risque de rechute
Traitement local
Il consiste en l’injection intra-articulaire de corticoïdes
– Peut être proposée en cas d’atteinte articulaire unique ou dans les formes d’évolution oligo- ou polyarticulaire (efficacité moindre que dans les autres formes d’AJI lorsqu’il existe des signes systémiques)
– Se fait sous prémédication ou anesthésie générale selon l’âge de l’enfant, le nombre et le type d’articulation à infiltrer
– Le geste doit être suivi d’un repos articulaire de 48h
Traitement antalgique
– Traitement antalgique de la maladie inflammatoire
. toute douleur prolongée ou mal contrôlée doit faire une discuter en 1ère intention une modification du traitement de fond
– En cas de douleur liée aux arthrites
. traitement antalgique utilisant des produits non opioïdes ou
. opioïdes faibles ou forts selon l’intensité de la douleur
. proposer des techniques non médicamenteux.
-
Formes polyarticulaires sans facteur rhumatoïde et formes oligoarticulaires
Objectifs
– Mise en rémission des manifestations articulaires aiguës
– Adaptation du traitement en fonction de l’évolution articulaire
– Dépistage et traitement de l’atteinte oculaire
– Dépistage et traitement de l’atteinte fonctionnelle articulaire
– Prévention et PEC des effets secondaires des traitement
– Assurer un bon développement psychosocial de l’enfant
Traitement médicamenteux systémique
En 1ère intention : AINS (voir ici)
En cas d’inefficacité et/ou d’intolérance aux AINS
En 1ère intention : Méthotrexate (MTX) seule ( ou en association à un AINS ou à un anti-TNFα possible sous surveillance +++)
– indiqué chez des enfants porteurs d’AJI polyarticulaire, oligo-articulaires étendues ou oligo-articulaires comportant plusieurs atteintes articulaires résistant à un traitement par AINS et injection intra-articulaires de corticoïdes
– 10-15 mg/m2/semaine per os sans dépasser 25mg/semaine
– Si échec du MTX per os ou en cas d’intolérance digestive, injection SC de la même dose (une augmentation de la dose à 30mg/m2/semaine n’apporte aucun bénéfice)
– Introduction précoce du MTX (efficacité se manifestant après 4-16 semaines de traitement)
– Contre-indication
. Insuffisance rénale sévère
. Insuffisance hépatique sévère
. Insuffisance respiratoire
. Infection évolutive
. Hypersensibilité à la substance active ou à l’un de ses excipients
– Effets secondaires
. Fréquentes : troubles digestifs, maux de tête, aphtes buccaux, manifestations hépatiques (hépatites le plus souvent réversibles après arrêt ou réduction de la dose)
. Rares : manifestations allergiques (éruption, œdème cutané), alopécie (réversible à l’arrêt du traitement), infections, manifestations hématologiques (leucopénie, thrombopénie, anémie), manifestations rénales (très rares), manifestations pulmonaires (atteinte pulmonaire interstitielle exceptionnelle)
En seconde intention : en cas d’intolérance ou d’efficacité insuffisante du MTX après 3 mois de traitement
– Anti-TNF α
. étanercept et adalimumab ont une AMM pour le traitement des AJI polyarticulaires (ou oligoarticulaires étendues) avec ou sans facteur rhumatoïde, en cas d’échec ou d’intolérance au MTX dès l’âge de 2 ans
. étanercept 0,8 mg/kg (sans dépasser 50mg) 1/semaine en SC
. adalimumab 24mg/m2 .Dose unique max = 20 mg (pour les patients de 2-4 ans) ou 40 mg (pour les patients de 4-12 ans) toutes les 2 semaines. Pour les patients à partir de 13 ans, 40 mg/2 semaines quelque soit la surface corporelle.
– Anticorps anti-récepteur de l’IL-6
. AMM en cas d’échec du MTX ou d’une 1ère biothérapie dans les AJI polyarticulaires dès l’âge de 2 ans
. Chez l’enfant < 30 kgs : 10mg/kg toutes les 4 semaines
. Chez l’enfant ≥ 30 kg : 8mg/kg/4 semaines
. Association possible avec MTX (amélioration et maintien du gain de réponse)
En troisième intention
– Le CTL A4-Ig (Abatacept) a une AMM pour la prise en charge des AJI polyarticulaires (ou oligoarticulaires étendues) avec ou sans FR, en cas d’échec ou d’intolérance à un anti-TNF α à partir de l’âge de 6 ans.
– 10mg/kg IV à J1, J15, J30 puis tous les mois
Le schéma ci dessous résume la stratégie thérapeutique dans les AJI associées à plus de quatre arthrites, à l’exclusion des formes systémiques d’AJI ((Childhood Arthritis and Rheumatology Research Alliance – 2014)
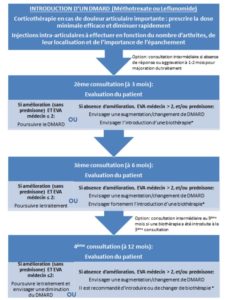
-
AJI associée aux enthésites
Objectifs
– Obtenir la rémission des manifestations articulaires
– Adapter le traitement en fonction de l’évolution articulaire et prévenir une éventuelle atteinte fonctionnelle
– Prévention et prise en charge des effets secondaires des traitements
– Assurer un bon développement psychosocial et staturo-pondéral de l’enfant
Indications thérapeutiques
En 1ère intention
– AINS : En 1ère intention en absence de contre-indication
– Injection intra-articulaire : en cas de persistance d’une ou deux localisations articulaires, le traitement local doit être proposé après les AINS (résultat évalué sur la disparition des arthrites et l’arrêt possible des AINS à 3 mois)
En cas d’inefficacité et/ou d’intolérance aux AINS
– L’évaluation se fait à 4 semaines
– Anti-TNF α doivent être envisagés lorsque l’atteinte articulaire s’étend ou persiste et/ou en cas de syndrome biologique persistant
– Etanercept ou Adalimumab en 1ère intention (efficacité et tolérance évaluées après 2 mois sur les paramètres cliniques et biologiques)
– Inflixumab
. Pas d’AMM
. Peut être proposé dans certaines formes réfractaires ou en cas de mauvaise observance à un autre anti-TNF
. 6mg/kg en IV à J1, J15 puis 1 fois par mois.
C) Suivi
-
FS-AJI
| Suivi |
| Rythme et contenu des consultations Clinique – Examen clinique complet . mesure de la taille et du poids . prise de la tension artérielle à chaque consultation – Une à plusieurs consultations (selon la sévérité) dans un centre de référence ou de compétences . suivi espacé proposé lorsque la maladie est inactive sans séquelle à prendre en charge – Le suivi peut être multidisciplinaire ( Pédiatre, médecin de MPR, Médecin interniste, kinésithérapeute, ergothérapeute, infirmier, diététicien, psychologue) Biologie – Hémogramme, CRP, VS, bandelette urinaire (recherche de protéinurie) : une à plusieurs fois par an (selon la sévérité de la maladie et du traitement) – Transaminases . contrôle itératif chez les patients traités par MTX (à titre indicatif, on peut proposer un contrôle dans le 1er mois suivant la première prise de MTX puis tous les 3 mois) . contrôle 1 ou 2 fois par an est proposé lors d’un traitement par AINS . contrôle trimestriel sous biothérapie, tant que la maladie est active puis espacé si le traitement est bien toléré – Bilan lipidique : initial puis l’intervalle est à discuter en fonction du traitement et des facteurs de risque – Créatininémie : 1 ou 2 fois/an chez les patients traités par AINS – Hémoculture, ECBU, Sérologies virales (en cas de suspicion d’infection chez un patient recevant une corticothérapie, un immunosuppresseur et/ou une biothérapie et en fonction du contexte clinique) – Bilan phosphocalcique (calcémie, phosphorémie, dosage de 25-OH-D3) . une fois/an en cas de facteurs de risque de survenue d’une ostéoporose (activité physique peu importante, corticothérapie prolongée, syndrome inflammatoire important persistant) Imagerie – Evaluation de l’atteinte ostéoarticulaire secondaire à l’AJI . suivi radiographique adapté à l’évolution . surveillance radiologique des mains/poignets et des pieds (atteintes polyarticulaires) . surveillance en échographie ou en IRM (atteinte clinique persistante) en cas d’atteinte des autres articulations (hanches notamment) – Recherche d’un foyer infectieux en cas de suspicion d’infection (patient recevant une corticothérapie, un immunosuppresseur et/ou une biothérapie) . les examens sont orientés en fonction du contexte clinique (radiographie pulmonaire, échographie, scanner ou IRM de l’organe atteint) Autres examens – Echographie cardiaque (en cas d’anomalie de l’examen cardiovasculaire ou annuelle en cas de maladie active persistante) – Cathétérisme cardiaque si suspicion d’hypertension artérielle pulmonaire – Suivi ophtalmologique : évaluation annuelle voire plus fréquente en cas de corticothérapie à forte dose – Ostéodensitométrie couplée à une évaluation de l’âge osseux et bilan phosphocalcique (calcémie et phosphatémie dans un premier temps en cas de symptomatologie clinique évocatrice d’ostéoporose ou de corticothérapie prolongée) |
| Evaluation de l’efficacité du traitement – Elle se fait en utilisant les paramètres proposés pour l’évaluation de médicaments lors des essais thérapeutiques au cours de l’AJI . évaluation par le médecin du niveau d’activité de la maladie sur l’échelle visuelle analogique (EVA) entre inactive et très sévère . évaluation par les parents et/ou le patient de l’état global sur l’EVA (si l’enfant a au moins 12 ans) entre excellent et très mauvais, par le test des figurines (si l’enfant a moins de 12 ans) entre joyeux et très triste . questionnaire d’évaluation des aptitudes fonctionnelles de l’enfant (Childhood Health Assessment Questionnaire) validé en français . nombres d’arthrites inflammatoires . nombre d’articulations présentant une limitation fonctionnelle . vitesse de sédimentation et/ou CRP – Amélioration de l’activité de la maladie est définie par une amélioration de la valeur d’au moins trois paramètres d’au moins 30% à condition qu’il n’y ait pas d’aggravation de plus de 30% de plus d’un des paramètres restants . pour la forme systémique, il faut y ajouter la disparition des manifestations systémiques comprenant la fièvre, l’éruption |
-
Formes polyarticulaires sans FR et formes oligoarticulaires
| suivi |
| Rythme et contenu des consultations Clinique – idem forme précédente – dans les formes oligoarticulaires peu sévères, une évaluation annuelle dans un centre de référence ou de compétences suffit Examen ophtalmologique – Examen systématique avec lampe à fente tous les 3 mois durant les cinq premières années puis tous les 6 mois entre la 5e et la 7e année d’évolution, ensuite tous les ans – En cas d’anomalies, le rythme et la durée de surveillance sont adaptés à l’atteinte inflammatoire oculaire Biologie – Hémogramme, CRP, VS, bandelette urinaire (recherche de protéinurie) . une à plusieurs fois par an en fonction de la sévérité de la maladie et du traitement . dans les formes oligoarticulaires peu sévères sans syndrome inflammatoire, aucun de ces examens n’est indiqué – idem que forme précédente Imagerie Surveillance de l’atteinte ostéoarticulaire : les radiographies sont effectuées selon l’évolution clinique et le type d’AJI – AJI polyarticulaires notamment pour les formes avec facteurs de mauvais pronostic . en cas de bon contrôle de la maladie : pas de radiographie systématique . en cas de mauvais contrôle de la maladie ou de dommage structural connu : le rythme de surveillance radiographique est à discuter en fonction de l’évolution clinique – AJI oligoarticulaire . en cas de bon contrôle de la maladie : pas de radiographie ou d’échographie systématiques . en cas d’atteinte persistante plus de 3 mois : radiographie des articulations concernés . en cas de mauvais contrôle de la maladie ou de dommage structural connu : rythme de surveillance radiographique à discuter en fonction de l’évolution clinique. Au besoin, la radiographie est aidée de l’échographie (selon compétences locales) à la recherche de synovite active résiduelle (il n’existe pas encore de protocole d’évaluation globale échographique validé) |
| Evaluation de l’efficacité du traitement – Idem forme précédente – Score d’activité de l’AJI (Juvenile Arthritis Disease Activity Score : JADAS), permet de suivre l’évolution de l’activité de l’AJI ; évaluant trois variables . compte articulaire des arthrites . EVA patient . EVA médecin – Les critères de Wallace permettent de définir la rémission clinique . absence d’arthrite, d’uvéite, VS et CRP normales . EVA médecin à 0 . dérouillage matinal de moins de 15 minutes – CHAQ |
D) Prévention
Elle consiste en la vaccination pour la prévention des infections. Le tableau ci dessous résume les vaccinations recommandées au cours de l’AJI
| Vaccin contre | indication et contre indication dans l’aji | Schéma vaccinal Recommandations (2017) |
| Diphtérie Tétanos Poliomyélite Coqueluche et Haemophilus Influenzae b (DTPCHIb) | Recommandé (PG) Aucune CI |
Age : 2, 4 et 11 mois, 6 ans, 11-13 ans, 25 ans puis tous les 10 ans |
| Hépatite A (HAV) | Recommandé si situation à risque* Aucune CI |
J0 et M6 |
| Hépatite B (HBV) | Recommandé (PG) Aucune CI |
Age : 2, 4 et 11 mois ou 3 doses à J0, M1 et M6 Rappels : non systématique sauf si Ac <10 UI |
| Méningocoque conjugué | C : Recommandé (PG) B et ACYW : si situation à risque** Aucune CI |
Méningocoque C – âge < 12 mois : 5 et 12 mois – âge > 12 mois : 1 dose unique Méningocoque B : – âge 2 – 5 mois : 3 doses /mois et rappel entre 12 et 23 mois – âge 6 – 11 mois : 2 doses /2 mois et rappel entre 12 – 24 mois – âge 12 – 23 mois : 2 doses /2M et rappel 12 à 23 mois plus tard. – 2 – 10 ans, 2 doses /2 mois Méningocoque ACYW – âge 6 semaines-2 ans (Nimenrix®) : J0, M2 et M12 – âge > 2 ans (Menveo®) : 1 dose unique |
| Pneumocoque | Recommandé Aucune CI |
En l’absence de vaccination antérieure – âge < 2 ans : vaccin pneumococcique conjugué 13-valent (VPC13) à M2, M3, M4, M11 puis vaccin pneumococcique non conjugué 23-valent (VPP23) > 2 ans et rappel VPP23 à 5 ans – âge 2-5 ans : VPC13 à J0 et M2 puis VPP23 M4 et rappel VPP23 à 5 ans – âge > 5 ans VPC13 puis VPP23 à M2 et rappel VPP23 à 5 ans Bien toléré et n’induit pas d’aggravation de la maladie. Moins immunogène que chez les sujets sains, surtout si la maladie est active et traitée par immunosuppresseurs (IS) : mesurer Ac anti-pneumocoque après pneumo 23 sous MTX |
| Grippe inactivé | Recommandé Aucune CI |
Fréquence : annuelle. Bien tolérée et n’induit pas d’aggravation de la maladie. Moins immunogène que chez les sujets sains, surtout si la maladie est active et traitée par immunosuppresseurs. |
| Papillomavirus (HPV) | Recommandé (PG) Aucune CI |
2 à 3 doses : – à J0 et M6 (11-13 ans) – ou J0, M2, et M6 (14-19 ans) |
| ROR (Rougeole Oreillon Rubéole) Varicelle Fièvre Jaune |
CI chez les patients immunodéprimés sauf si – Corticothérapie <2mg/kg/j ou ≤ 10mg/j eq. Prednisone et pas de traitement IS ou biothérapie – Corticothérapie > 2mg/kg/j ou > 10 mg/j depuis < 2 semaines en dehors des bolus (CI 3 mois) |
Dans le doute d’une infection antérieure ou efficacité d’une injection : sérologie ROR ou VZV. Si traitement IS urgent – ne pas vacciner le patient – protéger en vaccinant l’entourage si leurs sérologies sont négatives En cas de contage: Ig spécifiques ou polyclonales Si traitement IS non urgent – vacciner et différer de quatre semaines le traitement IS |
| BCG Grippe vivant |
CI chez les patients immunodéprimés | – |
* jeunes (>1 an) séjournant en structures collectives pour l’enfance et la jeunesse handicapées, enfants atteints de mucoviscidose ou de pathologie hépatobiliaire chronique susceptible d’évoluer vers une hépatopathie chronique (notamment dues aux virus de l’hépatite B et de l’hépatite C), enfants des familles dont l’un au moins des membres est originaire d’un pays de haute endémicité et susceptibles d’y séjourner, personnes dans l’entourage familial d’un patient atteint d’hépatite A.
** Asplénisme, greffe de cellule souches hématopoïetiques, déficit en fraction terminale du complément ou properdine ou traitement par anti-C5a




