1) Généralité 1A
Déf : obstruction partielle ou totale d’une ou plusieurs artères destinées aux membres inférieurs
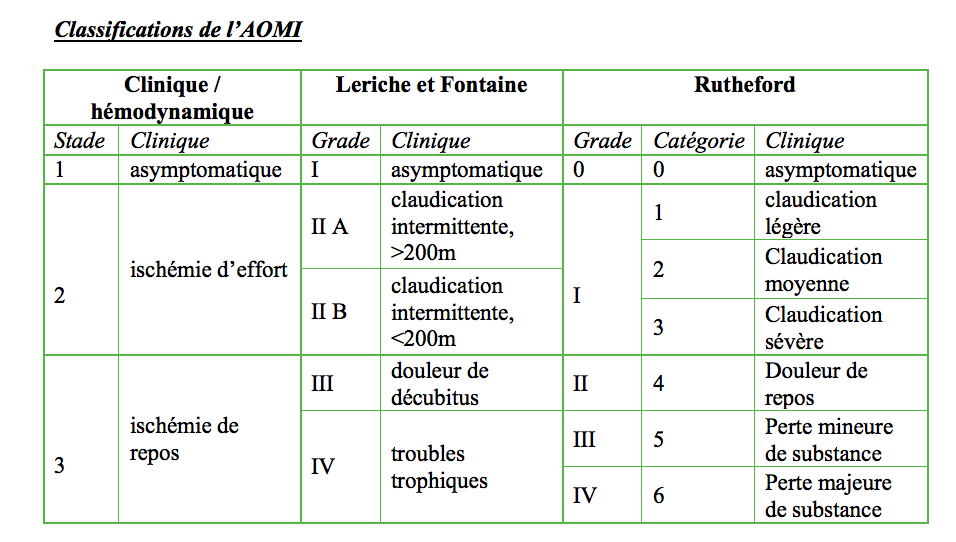
Stade : Il existe de nombreuses classifications, les 2 plus connues sont les classification de Leriche et Fontaine et de Rutheford.1B Actuellement, on préfère cependant utiliser une classification clinique et hémodynamique en 3 stades.1A
Epidémiologie : la prévalence augmente avec l’âge, > 20% après 70 ans 1A, 1 à 2% dans la population générale 1B
Etiologies 1B
– Maladie athéromateuse des membres inférieurs ++ (> 95%), avec une importance particulière du tabagisme et du diabète.
– Vascularites : Buerger, Takayasu, Horton, PAN, lupus…
– Dysplasie fibromusculaire iliaque ou poplité
– Coarctation de l’aorte
– Kyste poplité piégé ou artère poplitée piégée
– Autres : atteintes toxiques (ergot de seigle…), post traumatiques ou post-radiques
2) Diagnostic 1A
| clinique | Paraclinique |
|---|---|
| IPS < 0,9 | ± échodoppler, test de marche |
A ) Clinique
Les signes fonctionnels et physiques s’additionnent avec les stades. Le diagnostic est porté par l’IPS
IPS : rapport PAS cheville / PAS brachiale
Mesure habituelle de la PA au 2 bras, et à la cheville grâce à un doppler de poche, PA des artères tibiales antérieure et postérieure.
> Une valeur < 0.9 permet le diagnostic d’AOMI
> Une valeur > 1.4 signe une incompressibilité artérielle (âge, diabète, IRC avec médiacalcose). Il faut alors prendre la PAS de l’hallux pour porter le diagnostic d’AOMI (rapport < 0.7 dans ce cas 1B)
-
Stade 1 (asymptomatique)
Anamnèse : Asymptomatique ! Découverte fortuite ou au décours d’un bilan athéromateux. Une recherche doit être systématique en cas :
– > 40 ans et diabète
– > 50 ans et FdR CV
– > 70ans
– Bilan de maladie athéromateuse
Clinique
– Abolition d’un pouls
– ± Présence d’un souffle
– Indice de pression systolique IPS < 0.9
-
Stade 2 (ischémie d’effort)
Anamnèse : douleur typique d’installation progressive
– A type de crampe, survenant dans un même territoire musculaire à la marche, après une même distance de marche
– Majorée par la durée et l’intensité de l’effort (marche rapide / en côte)
– Imposant l’arrêt de l’effort
– Disparaissant en < 5 min habituellement 1B (ou <10 min 1A)
| Topographie des douleurs : en aval du segment artériel lésé | |
|---|---|
| Artères jambières | Pied |
| Fémoro-poplitées | Mollet |
| Iliaques | Cuisse |
| Iliaques internes ou communes | Fesse |
Clinique
. PAS cheville > 50 mmHg
± Signes d’anévrisme (aorte abdo, poplitée…)
-
Stade 3 (ischémie de repos)
Signes évoluant depuis au moins 15j
Anamnèse : Douleurs distales résistant aux antalgiques de pallier 1 et 2, soulagée par la position déclive (jambe pendante hors du lit)
Clinique
. PAS cheville < 50 mmHg ou PAS orteil < 30 mmHg
. Pâleur, érythrocyanose
± œdème du pied et de la jambe lié à une position déclive permanente
± troubles trophiques :
– Ulcère : généralement au pied, creusant jusqu’à l’articulation, hyperalgique
– Gangrène sèche ou humide en cas de processus infectieux associé
– Nécrose cutanée
-
Remarque : l’AOMI chez le diabétique
Chez les patients diabétique, l’AOMI est fréquente et atypique :
– Age de début plus précoce
– Douleurs atypiques, distales, longtemps absentes à cause de la neuropathie (notamment ulcère parfois indolore)
– Médiacalcose menant à une surestimation de l’IPS et retardant le diagnostic
– Risques infectieux et trophique surajouté (différentiel mal perforant plantaire / AOMI)
B ) Paraclinique 1B
Utile à partir du stade 2, permet de confirmer le diagnostic.
Angioscanner (1ere intention) : topographie et type de lésions, mesure des vitesses circulatoires. Dépistage des anévrismes
Angio-IRM ou artériographie ssi revascularisation envisagée
Remarque : les 2 examens suivants ne sont plus recommandés
– Echo-doppler artériel de l’aorte et des MI : topographie et type de lésions, mesure des vitesses circulatoires. Dépistage des anévrismes
– Test de marche : méthode standardisée sur tapis roulant pour déterminer une distance de marche, après avis cardiologique. On mesure la PAS à la cheville avant le test, à l’apparition de la douleur et à sa récupération complète. Une AOMI provoquera une baisse de tension à l’arrêt de l’effort. 1A . Résultats 1B : une baisse > 30 mmHg et/ou > 20% de l’IPS après effort sont en faveur d’une AOMI.
C ) Diagnostic différentiel
De la claudication :
– veineuse
– articulaire
– neurologique
Des troubles trophiques :
– ulcère veineux
– mal perforant plantaire
– angiodermite nécrotique
3) Evolution 1A
Pronostic est conditionné par l’histoire naturelle de l’AOMI, qui suit la classification de Leriche et Fontaine et les autres atteintes de la maladie athéromateuse
– Au stade 2: espérance de vie réduite de 10 ans. A 5 ans: 20% auront des complications CV. 20% vont décéder dont la moitié de causes CV. 25% auront une aggravation de leur artériopathie –> 5% d’amputation. 1B
– Au stade 3: 70% de décès à 5 ans 1B
Mortalité
– 15% à 5 ans au stade de claudication intermittente
– 25% à 1 an au stade d’ischémie permanente chronique
Remarque : 2 complications cliniques particulières
– Ischémie aigüe de membre
– Syndome de Leriche = lésions oblitérantes aorto-iliaques réalisant un tableau d’AOMI + dysfonction érectile
4) PEC 1A
A ) Bilan
Bilan de la maladie athéromateuse, avec au minimum
– Examen clinique
– ECG et échographie de l’aorte abdominale
– Recherche d’insuffisance cardiaque : ETT et BNP 3
– Epreuve d’effort ou scinti myocardique ou écho de stress systématique chez le diabétique
Bilan de gravité de l’AOMI stade 2
– Echo-doppler, Test de marche
– Angio-TDM ou angio-IRM ssi une revascularisation est envisagée
Bilan de gravité de l’AOMI stade 3
– Echo-doppler artériel + 1 autre imagerie (artériographie, angio-TDM ou angio-IRM)
– TcPO2*
– Angiographie si atteinte sévère en dessous du genou (« chronic limb-threatening ischemia with below-the-knee lesions ») 3
* Remarque sur la TcPO2 : la pression partielle en oxygène estime la gravité de l’ischémie, elle devient < 30 mmHg au stade d’ischémie permanente chronique 1A et < 10 mmHg en cas d’hypoxie critique 1B
En pratique elle est demandée pour apprécier la capacité d’une plaie à cicatriser, le résultat d’une revascularisation, déterminer un niveau d’amputation… 0
B ) Traitement
Mesures générales
– PEC de la maladie athéromateuse et des FdR CV (stade 1)
– Réadaptation à l’effort, programme d’éducation thérapeutique (stade 2)
– PEC des complications : SAT-VAT, prévention du risque d’escarre et du risque infectieux, PEC nutritionelle (stade 3)
Traitement médicamenteux
– Statine (stade 1, systématique 1A, même après revascularisation 3)
– IEC (stade 1, systématique !)
– Aspirine ou Clopidogrel (stade 2 ; stade 1 selon risque vasculaire1A, voire systématique1B, ). Préférer le clopidogrel à l’aspirine (grade IIb) 3.
– HBPM pour prévenir la maladie thrombo-embolique (stade 3)
– Ttt palliatif si impossibilité ou échec de la revascularisation (stade 3) : perfusions de prostaglandines (ILOMEDINE)
– Antalgique, jusqu’à morphinique (stade 3)
Revascularisation (stade 3, ± stade 2)
Indications :
– systématique au stade 3 (si possible),
– discutée au stade 2 en présence de lésions menaçantes, avec claudication invalidante malgré un traitement bien conduit durant > 3 mois au stade d’ischémie d’effort (ou stade 2 avec périmètre de marche < 100m avec handicap fonctionnel important et/ou atteinte aorto-iliaque sévère 1B)
2 techniques
– Angioplastie trans-luminale ATL : technique endoluminale (ballonnet ± stent). Ne pas oublier la bi-antiagrégation plaquettaire pendant 1-6 mois 1B
– Chirurgie ouverte : pontage (avec grande saphène en 1ère intention pour les lésions sous-poplitées, grade I 3), endartériectomie
Amputation : en cas d’échec / impossibilité de la revascularisation, pour limiter les complications infectieuses (stade 3).
Suivi régulier clinique et échographique





6 réponses à “Artériopathie oblitérante des membres inférieurs”
l’indication des examens complémentaire (pour le diagnostic positif ou le bilan) n’est pas clair dans les 2 référentiels… Par exemple, un écho-doppler est-il systématique devant une AOMI stade 1 avant de commencer les traitements par statine et IEC ?
Effectivement non précisé dans le collège de cardio mais difficile de se passer d’un echo-doppler en cas d’abolition d’un pouls ou d’une diminution des IPS non ?
l’écho doppler n’est même plus recommandé dans le ref. de cardio en première intention…
La partie « bilan au stade 2 » (depuis le ref 2015 de vascu) n’est pas cohérent avec le reste.
A voir avec le ref 2019 de vascu ??
Y a t’il une indication à mettre du xarelto 15 mg + kardegic à la place du plavix + kardegic chez une patiente stade IIa avec stenose fémorale superficielle >80% (patiente par ailleurs diabetique 1)
D‘après les sources utilisées dans cette fiche il n‘y a pas de place pour les anticoagulants, sauf HBPM au stade 3 dans la prévention de la MTEV.
Voir notamment la guideline ESC 2017 très complète.
D‘où vient cette „idée“ de traitement ?!
d’un médecin angiologue je suis également très surprise maintenant elle a même Xarelto et duoplavin… on est mal barré